今回から3回にわたり講師をしていただくのは、国立国際医療研究センター・細胞組織再生医学研究部 部長の大河内仁志 先生です。先生の研究室では「iPS細胞から膵島を作る」というテーマでご研究をされております。
本回(第21回)は、膵島とはなにか?なぜ iPS細胞から膵島を作製する必要があるのか?といった背景・問題提起から、iPS細胞から分化誘導した膵島細胞のマウスでの性能評価についてご寄稿いただきました。
表や図も交えてご寄稿いただきましたので、とてもわかりやすく、視覚的にも楽しんでいただける内容かと思います。ぜひご覧くださいませ。
■ 講師紹介ページ: 国立国際医療研究センター 大河内 仁志 先生
"今なぜiPS細胞から膵島作製が必要なのか? "
国立国際医療研究センター
細胞組織再生医学研究部 部長
大河内 仁志 先生
膵島とは
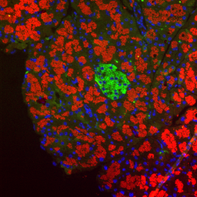
膵臓は、消化酵素を腸に放出する外分泌腺と、インスリンなどのホルモンを血液中に放出する内分泌腺からなる臓器である。膵臓内の内分泌腺は外分泌腺に取り囲まれており、あたかも島のように散在しているため、膵島またはランゲルハンス島と呼ばれている(下図の緑色が膵島で、赤色が外分泌腺。文献2より引用)
1型糖尿病
膵島でインスリンを産生する細胞をβ細胞と呼ぶが、インスリンの分泌不全により、血糖のコントロールができなくなると糖尿病になる。糖尿病にも色々な病型があり、通常の生活習慣病と言われている糖尿病は2型に分類される。1型糖尿病は特殊型で、自分の免疫細胞によってβ細胞が攻撃されてしまうことが原因の自己免疫疾患である。
1型糖尿病患者はインスリンを産生できないので、毎日のインスリン注射が欠かせない。一方でインスリンが効きすぎると、低血糖発作を起こしてしまう。インスリン注射でうまく血糖値をコントロールできずに低血糖発作を繰り返して、日常生活に著しい支障をきたす場合は膵島移植の適応になる。
膵臓・膵島移植
脳死患者から提供された膵臓は、まずは膵臓移植に優先使用される。膵臓と腎臓の同時移植がしばしば行われている。膵臓移植に適さない場合に膵島移植が考慮される。膵臓移植は開腹手術が必要で、血管をつなぎ、腸への消化酵素の排出経路を確保するために高度な技術が要求される。
一方、膵島移植では摘出された膵臓から酵素処理によって膵島だけを単離し、点滴バッグに入れて、患者の門脈に注入する。移植された膵島は肝臓内で生着し、うまくいけば日々のインスリン注射から解放される。
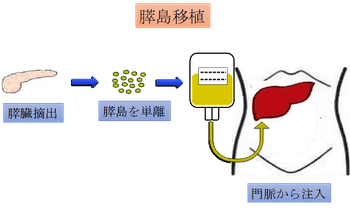
インスリン依存性の1型糖尿病患者に対しては膵臓全体の移植は不要で、原則として膵島細胞のみ移植できれば良いと考えられている。局所麻酔で実施できるので、膵臓移植よりも患者への負担は軽減される。日本では年間の脳死による臓器提供は100例前後のため、根本的な問題としてドナー不足が挙げられる。現在、膵島移植を望む患者が120名以上いるが、実際には膵島移植は1年間で数例しか行われていない。
そこで、ドナー不足を解決するために、多能性幹細胞であるES細胞(Embryonic Stem cell:胚性幹細胞)やiPS細胞の利用が注目されている。これらの細胞は無限に増殖できる能力があり、どんな細胞にもなれる万能性もあるので、移植用の膵島が作製できると考えられた。
ES細胞から膵島を誘導
ヒトES細胞から膵島を誘導する研究は2006年のD’Amourの発表(文献1)以後、多くの報告がなされている。我々は浅島誠先生(当時:東大教授)との共同研究で、2007年にマウスのES細胞からミニチュアの腸管と膵臓が同時に誘導できることを報告した(文献2)。ES細胞を凝集塊にして胚様体を作成し、培養液にレチノイン酸とアクチビンを加えることが鍵であった。しかしこのミニチュアの組織は血管がないために、培養液の浸透できる直径1-2mm程度の大きさまでしかサイズを維持できないことも判明した。
iPS細胞から膵島を誘導
ES/iPS細胞から膵島を分化させる方法は、実際の膵島の発生過程を参考にして、5−6段階に分けて、添加因子を変えつつ培養環境を整えている。
我々もヒトiPS細胞を用いて、ES細胞で報告されている分化方法をいくつか試してみたが、再現ができなかった。ES細胞やiPS細胞は細胞株ごとに性質が違うため、それぞれの細胞株に合わせた条件検討が必要と考えられた。
当研究部の上級研究員の矢部茂治博士の精力的な検討により、接着培養でヒトiPS細胞から膵島に分化させる独自の23日間、6段階プロトコールを完成させた(文献3)。その特徴は、分化の第1段階である原始内胚葉(Definitive Endoderm)への分化法を工夫したことである。
発生過程では肝臓と膵臓は同じ内胚葉組織から形成されるので、人工的に誘導した原始内胚葉から両者を分化誘導することができる。肝臓にはならずに、膵臓にだけ分化するように添加因子を工夫した。後半の培養過程では外分泌腺にはならずに、膵島(内分泌腺)にだけに分化するように仕向けた。
実際に膵島細胞が誘導できて、インスリンを産生する細胞を確認した。β細胞はただインスリンを産生するだけではなく、血糖値(ブドウ糖濃度)に合わせてインスリンの産生量を調節する機能(グルコース応答性)が非常に重要である。
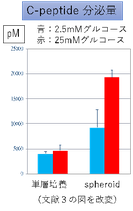
多くの研究者はES細胞やiPS細胞からインスリン産生細胞の誘導には成功していたが、グルコース応答性がないことに苦しんでいた。我々の場合も、下図のように単層培養(接着培養)のままでは、グルコース応答性が認められなかった。ところが、分化の最後のステップにおいて、接着細胞を剥がして、3次元的に凝集塊(spheroid)を作製した。すると、2.5mMの低グルコース濃度から25mMの高グルコース濃度に変えると、より多くのc-peptide(*)を分泌した。すなわちグルコース応答性をもつβ細胞が誘導できた。
*c-peptide:インスリンが産生される時にインスリン前駆体から切断される断片で、一緒に分泌される。インスリン分泌量の指標になる。
マウスへの移植実験
iPS細胞から誘導した膵島で十分なインスリン分泌が認められたので、糖尿病モデルマウスに移植すれば、さぞ効果があるだろうと期待した。ヒトの細胞が拒絶されないように免疫不全マウス(NOD/SCID)を用いた。マウスにストレプトゾトシンという抗がん剤の1種を投与して、β細胞を選択的に破壊し、1型糖尿病モデルマウスを作製した。
実際にマウスの腎臓の被膜下に6x10の6乗個の細胞を移植してみると、確かに20匹中6匹では血糖降下作用が認められた。ヒト由来のc-peptideとマウス由来のc-peptideは構造が異なるので、ELISA法で区別して測定できる。血糖降下作用が認められたマウスの血中には確かにヒト由来のc-peptideが分泌されていた。
またマウスの腎臓を摘出して、免疫組織学的に検討すると、ヒトc−peptide陽性のβ細胞とグルカゴン陽性のα細胞が生着していた。血糖降下作用が認められなかったマウスでは、何らかの原因で移植時にダメージを受けて、細胞がうまく生着できなかったと考えられた。
参考文献
1 D'Amour KA et al. Production of pancreatic hormone-expressing endocrine cells from human embryonic stem cells. Nat Biotechnol 2006;24:1392-401.
2 Nakanishi M et al. Pancreatic tissue formation from murine embryonic stem cells in vitro. Differentiation 2007;75:1-11.
3 Yabe SG et al. Efficient generation of functional pancreatic beta-cells from human induced pluripotent stem cells. J Diabetes 2017;9:168-179.
当社Facebookページをフォローしていただきますと、Kyokutoブログ等の情報をいち早く入手できます。こちらもどうぞご覧ください。
この記事に関するお問合せはこちら
cellculture@kyokutoseiyaku.co.jp
-

-
【特別講義 第25回】竹内先生インタビュー連載記事Vol.2
【出展案内】 11/25-27 バイオEXPOに出展します!
【お知らせ】順天堂大学およびJUNTENBIOとの共同研究について
【出展案内】再生医療JAPAN/BioJapanに出展します!
【特別講義 第24回】竹内先生_インタビュー連載記事Vol.1
【特別講義 第23回】iPS細胞から誘導した次世代型膵島の臨床応用を目指して
【出展案内】2/26-28再生医療EXPO大阪に出展します!
【特別講義 第21回】今なぜiPS細胞から膵島作製が必要なのか?
【技術情報】Stem-Partner SF/ACF(ラミニン添加法)
【掲載情報】PHARMSTAGE (2019.3)に掲載されました
【特別講義 第17回】iPS細胞から分化した神経系細胞を用いた再生医療前臨床および疾患モデル研究
【特別講義 第16回】ES/iPS細胞から神経幹細胞を誘導する
【掲載報告】9/27「化学工業日報」再生医療特集に掲載されました
【お知らせ】技術情報の更新(4/16)
【特別講義 第13回】常在菌と病原菌の狭間(前編)(2/8)
【講師紹介】東京女子医科大学 菊池賢先生(1/23)
【特別講義 第12回】腸上皮培養の今後と応用(10/31)
【特別講義 第11回】 腸上皮オルガノイド培養 (09/29)
【特別講義 第10回】 腸上皮組織と幹細胞 (09/08)
【講師紹介】東京医科歯科大学 中村哲也先生(09/08)
【特別講義 第9回】なぜT細胞だけが胸腺で分化するのか (06/26)
3製品の技術情報ページを更新しました! (06/16)
【特別講義8】免疫反応の制御と制御制T細胞 (02/24)
【主席研究員部屋7】 水は培地の生命です (01/18)












