講師は前回(細胞培養 特別講義 第22回)に引き続き、国立国際医療研究センターの大河内仁志先生です。前回は、「iPS細胞から膵島の大量培養法の開発」というテーマで、臨床応用に向けた大量培養法のご検討エピソードをご紹介いただきました。
今回は、膵島移植における問題点からその解決方法の検討や海外動向についてご寄稿いただきました。臓器移植等で問題に挙がる「拒絶反応」が起こりにくく、患者への負担を最小限に抑えるためにはどのような方法で移植するのが良いのか、また、海外におけるES/iPS細胞から誘導した膵島細胞の投与検討などを交え、大河内先生の研究室の今後の展望や課題についてご紹介いただきます。
どうぞご覧くださいませ。
■ 講師紹介ページ: 国立国際医療研究センター 大河内 仁志 先生
■ 第21回:今なぜiPS細胞から膵島作製が必要なのか?
■ 第22回:iPS細胞から膵島の大量培養法の開発
" iPS細胞から誘導した次世代型膵島の臨床応用を目指して "
国立国際医療研究センター
細胞組織再生医学研究部 部長
大河内 仁志 先生
現在の膵島移植の問題点
膵島移植は1型糖尿病患者に対する有効な治療法である。しかしドナー不足以外にもう一つ問題がある。提供される膵島は他人由来なので、免疫抑制剤を使用しないと拒絶反応が起きてしまう。患者は膵島移植後に免疫抑制剤の長期間投与を受けなければならない。免疫抑制剤は高価な上に、長期に連用すると肝臓や腎臓などへの臓器障害や、腫瘍発生などの副作用のリスクが高まる。
そこで、免疫抑制剤を使用しない治療法の開発が望まれている。世界中で膵島細胞をデバイスに入れて、免疫細胞から隔離することで、攻撃を逃れる方法が検討されている。
膵島のカプセル化
ES/iPS細胞には奇形腫の形成能があるため、移植細胞に未分化細胞が残っていると、腫瘍化するリスクがある。カプセル化することで取り出し可能となれば、万一腫瘍化した場合にも、安全性が担保できるというメリットがある。
カプセル化して体内に入れるためには、カプセルの材質は生体に無害なものでなくてはならず、内部の細胞の生存のために栄養分や酸素の透過性が要求される。生体適合性に優れたものとして海藻から抽出されたアルギン酸がある。アルギン酸ゲルはドロッとした液状であるが、カルシウムやバリウムイオンによって架橋されると固化する性質がある。固まっても網目構造になっているので、小分子は通過できる。
我々はiPS細胞から誘導した膵島をアルギン酸ゲルに混ぜて、ファイバー状のものを作製した。注射器で塩化バリウム溶液中に押し出すことにより、下図(右図:文献1より引用)のようにiPS細胞由来の膵島細胞をアルギン酸に封入して、1本のファイバーにした。
マウスへの移植実験
アルギン酸ファイバーに封入した膵島を糖尿病モデルマウスの皮下と腹腔内に移植して、移植部位の検討を行った。腹腔内へのファイバー移植では腎被膜下の2倍となる1.2x107個の細胞が血糖値の正常化に必要であった(下図の青線)。ファイバー内の細胞は血管と接していないので、分泌されたインスリンは拡散によって血管内に入る。したがって、移植細胞が毛細血管に接触できる腎臓の被膜下移植と同じレベルの血液中のインスリン濃度を達成するためには、より多くのインスリンを産生する必要があると考えられた。一方で、同様にファイバーを皮下に移植した場合は、血糖は軽度降下したが、正常化には至らなかった(下図の赤線)。
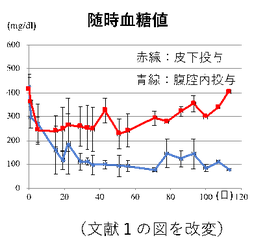
また腹腔内に移植したファイバーは16週間後に、ピンセットで容易に取り出せたが、皮下に移植したものはファイバーが一塊となって線維性被膜に覆われていた。組織学的に検討すると、線維組織に覆われても、中の細胞は生存していたので、最低限の栄養と酸素は確保されていると考えられた。ただインスリンの分泌量が不十分で、血糖のコントロールはうまくできなかったと考えられた。
アルギン酸ファイバーの問題点
第1に、ヒトへのアルギン酸の投与量が問題となる。マウスへの移植にはアルギン酸を約1.5ml使用したが、ヒトで2000倍必要となると、3Lになってしまう。インスリン注射を不要にするための腹腔内への投与量としては多すぎる。
第2に、アルギン酸ファイバーの強度が問題になる。生体内ではバリウムイオンが徐々に溶け出して失われるので、時間が経つとファイバーが脆くなる。実際に、6ヶ月以上マウス体内に存在したファイバーは切れてしまった。動物実験には使えても、このままではデバイスの安定性という点が問題になるので、強度を上げる必要がある。
マーモセットの糖尿病モデル作製
国立国際医療研究センターには膵島移植プロジェクトという部門があり、霜田雅之プロジェクト長が実際にヒトでの膵島移植を行なっている。膵島移植には膵島の単離に高度な技術と経験が要求されるので、全国で膵島移植を行えるのは10施設しかない。膵島移植はまだ保険が使えないので、現在は先進医療B制度のもとで、臨床試験として実施されている。
iPS細胞から誘導した膵島細胞はマウスへの投与実験で効果を確認できた。マウスとヒトでは種差があるので、次に霊長類での効果を検討する必要がある。霜田先生との共同研究で最近、コモンマーモセットの糖尿病モデルの作製に成功した(文献2)。マーモセットは霊長類でありながら、体重が300g程度と軽いので、移植実験には細胞数が少なくて済むメリットがある。マウスのようにストレプトゾトシンの投与だけでは糖尿病にならない。そこで膵臓を70%切除した後にストレプトゾトシンを投与することで、糖尿病モデルができた。現在この動物モデルを使用して移植実験を行っている最中である。
海外の動向
世界中でES/iPS細胞由来の膵島細胞をデバイスに入れて、1型糖尿病患者に投与する計画が進行中である。
米国ではViaCyte社がヒトES細胞由来の膵島前駆細胞(PEC-01™)を独自のデバイスに入れて、1型糖尿病患者に皮下投与する治験を2016年から開始した。2018年の報告によると、わずかの細胞しか長期生存しておらず、デバイスに対する異物反応が起きていた。デバイスを変更する予定とのことで、必ずしもうまくいっているわけではない。
やはり米国のSemma Therapeutics社はヒトES細胞由来の膵島細胞をデバイスに入れて、ブタと霊長類に投与して、前臨床データを取得していることが報告されている。
我々もiPS細胞由来の膵島細胞をデバイスに入れて、次世代型膵島移植療法として臨床応用したいと考えている。やはり免疫抑制剤の使用は避けたいので、新規デバイスの開発が喫緊の課題である。また細胞の機能を保持したまま凍結保存できる技術の開発も、必要と考えている。
参考文献
1. Fukuda S et al. The Intraperitoneal Space is more Favorable than the Subcutaneous one for Transplanting Alginate Fiber Containing iPS-derived Islet-like Cells. Regen Ther. 2019;11:65-72.
2. Yuan W et al. Establishment of a diabetes mellitus type 1 model in the common marmoset. Sci Rep 2019;9(1):14546.
フォームが表示されるまでしばらくお待ち下さい。
恐れ入りますが、しばらくお待ちいただいてもフォームが表示されない場合は、こちらまでお問い合わせください。
当社Facebookページをフォローしていただきますと、Kyokutoブログ等の情報をいち早く入手できます。こちらもどうぞご覧ください。
この記事に関するお問合せはこちら
cellculture@kyokutoseiyaku.co.jp
-

-
【特別講義 第25回】竹内先生インタビュー連載記事Vol.2
【出展案内】 11/25-27 バイオEXPOに出展します!
【お知らせ】順天堂大学およびJUNTENBIOとの共同研究について
【出展案内】再生医療JAPAN/BioJapanに出展します!
【特別講義 第24回】竹内先生_インタビュー連載記事Vol.1
【特別講義 第23回】iPS細胞から誘導した次世代型膵島の臨床応用を目指して
【出展案内】2/26-28再生医療EXPO大阪に出展します!
【特別講義 第21回】今なぜiPS細胞から膵島作製が必要なのか?
【技術情報】Stem-Partner SF/ACF(ラミニン添加法)
【掲載情報】PHARMSTAGE (2019.3)に掲載されました
【特別講義 第17回】iPS細胞から分化した神経系細胞を用いた再生医療前臨床および疾患モデル研究
【特別講義 第16回】ES/iPS細胞から神経幹細胞を誘導する
【掲載報告】9/27「化学工業日報」再生医療特集に掲載されました
【お知らせ】技術情報の更新(4/16)
【特別講義 第13回】常在菌と病原菌の狭間(前編)(2/8)
【講師紹介】東京女子医科大学 菊池賢先生(1/23)
【特別講義 第12回】腸上皮培養の今後と応用(10/31)
【特別講義 第11回】 腸上皮オルガノイド培養 (09/29)
【特別講義 第10回】 腸上皮組織と幹細胞 (09/08)
【講師紹介】東京医科歯科大学 中村哲也先生(09/08)
【特別講義 第9回】なぜT細胞だけが胸腺で分化するのか (06/26)
3製品の技術情報ページを更新しました! (06/16)
【特別講義8】免疫反応の制御と制御制T細胞 (02/24)
【主席研究員部屋7】 水は培地の生命です (01/18)














